4 生殖補助医療(ART)
(1) 体外受精・胚移植、顕微授精
生殖補助医療(ART)とは
体外受精・胚移植など、生殖に関わる技術を総称して生殖補助医療(assisted reproductive technology; ART)と呼びます。
1978 年に体外受精・胚移植が不妊症の治療法として登場し、イギリスで体外受精児第1 号が誕生したところに始まります。以来、体外受精・胚移植の技術の改善や関連した新しい技術が次々と開発され、不妊症の治療法は飛躍的に発展しました。
日本では1982 年から体外受精・胚移植が臨床応用され、現在では大病院から一般の診療所まで幅広く行われています。生殖補助医療は難治性不妊症に対する重要な治療法として位置付けられています。
体外受精・胚移植の適応
| 1.卵管性不妊症 | 薬物療法、手術の奏効しない症例 |
|---|---|
| 2.男性不妊症 | 薬物療法、手術など一般的な治療が奏効しない症例で、数回の人工授精を行っても妊娠しなかった症例 |
| 3.子宮内膜症 | 薬物療法、手術の奏効しない症例 |
| 4.免疫性不妊(抗精子抗体陽性例) | |
| 5.原因不明不妊 | 一定期間の積極的治療によっても妊娠しない症例 |
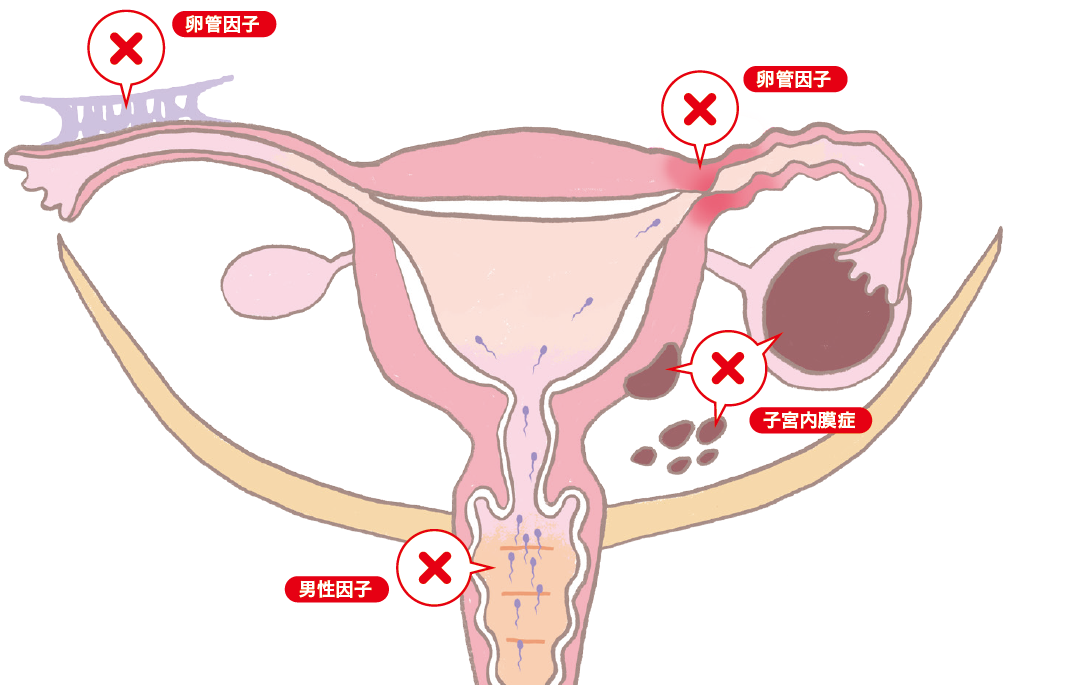
体外受精・胚移植の対象となる患者さんは、表3に示したような方です。
体外受精は卵管障害を対象として始まりましたが、他の不妊原因に対しても治療が十分行われた延長線上の治療法として適応が拡大しました。生殖補助医療以外の治療で妊娠できる可能性があるものでも、いたずらに治療の反復により経過を遷延させることは望ましくなく、安直に生殖補助医療へ誘導するべきでもありません。一般的な治療法を十分試みた上で妊娠が成立しない場合は、治療歴や年齢を考慮に入れ、タイミングを逸することなく生殖補助医療へ移行することが重要です。
体外受精・胚移植の概要
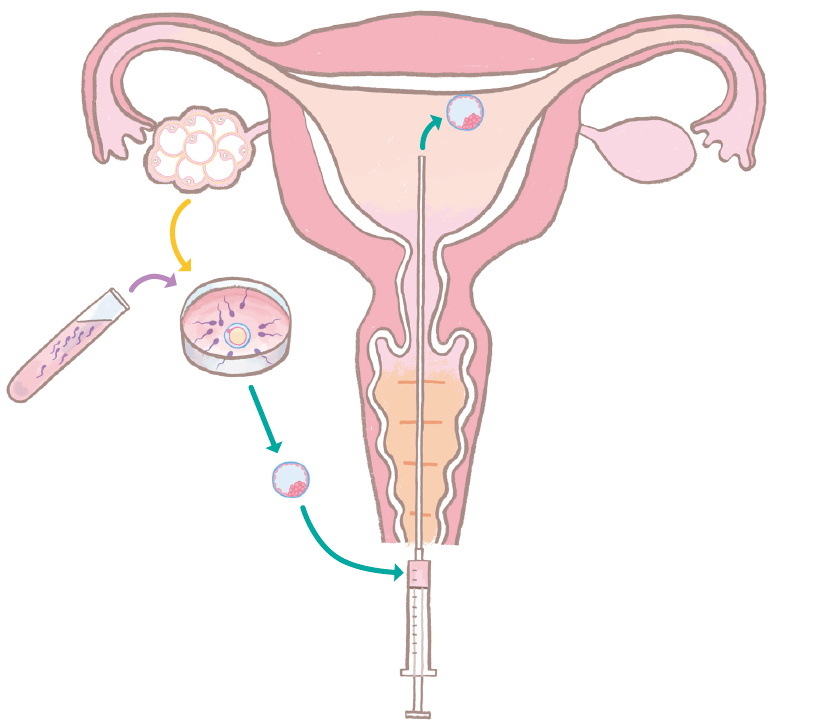
体外受精・胚移植では、卵巣刺激により複数個の成熟卵胞を発育させ、採卵術によりそれぞれの卵胞から卵子を採取します。図9のように、卵子は運動精子とともに培養されます(媒精→17頁)。
この結果、受精が確認された卵はさらに培養を続け、受精卵(胚)として子宮内に経腟的に移植されます。移植された胚が子宮内膜に着床すると妊娠が成立します。
体外受精・胚移植の実際
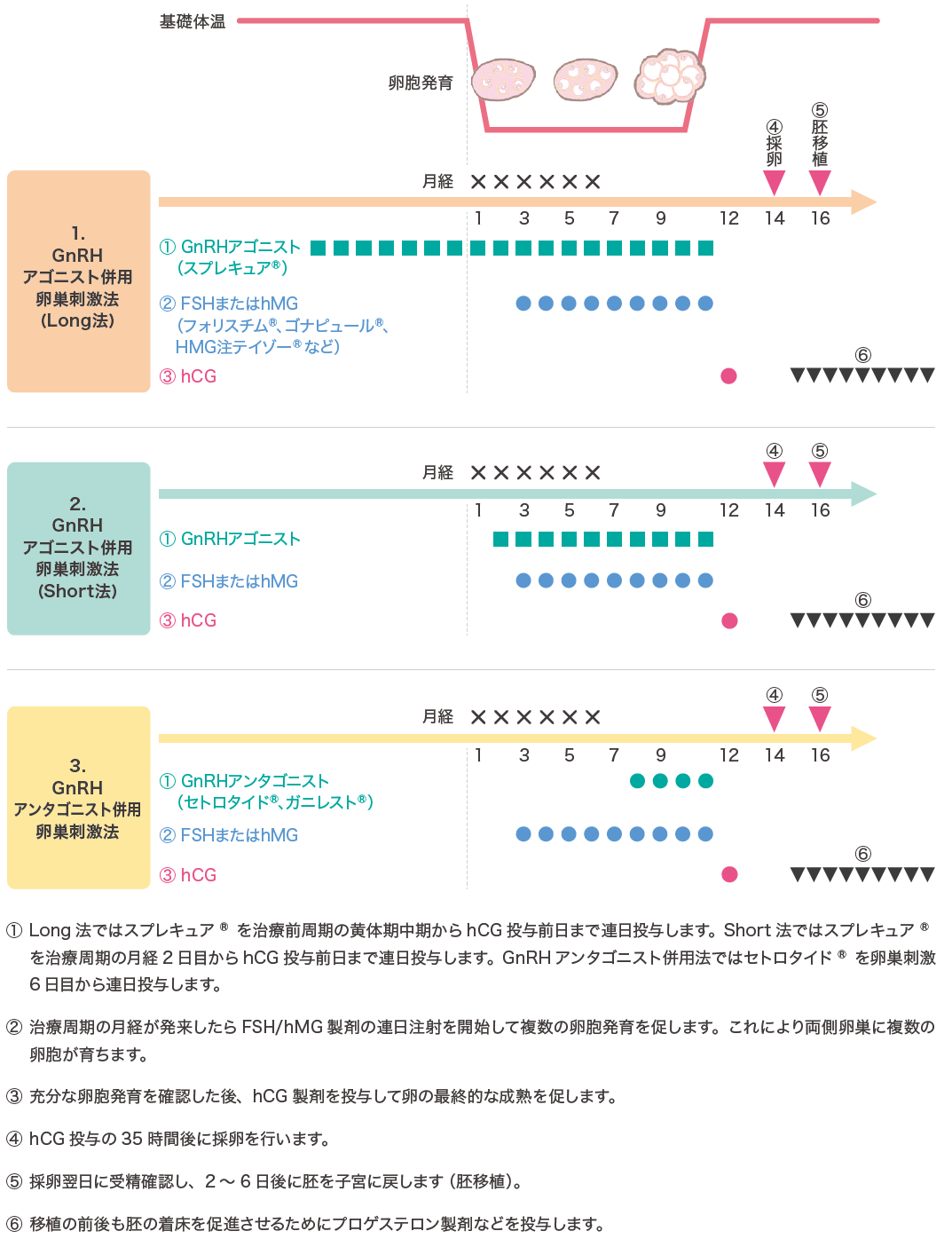
1)卵巣刺激
体外受精では効率よく治療を行うために、一度の治療で複数個の成熟卵子を受精させ、培養することが必要です。そのためにGnRH(ゴナドトロピン放出ホルモン)アゴニスト製剤、GnRHアンタゴニスト製剤、FSH(卵胞刺激ホルモン)製剤、hMG(ヒト閉経期性腺刺激ホルモン)製剤、hCG(ヒト絨毛性性腺刺激ホルモン)製剤を用いた卵巣刺激を行います。
主な薬剤には、GnRHアゴニスト製剤として酢酸ブセレリン(スプレキュア®)、GnRHアンタゴニスト製剤として酢酸セトロレリクス(セトロタイド®)、FSH製剤としてフォリスチム®、ゴナピュール®、hMG製剤としてHMG注テイゾー®、hCG製剤としてHCGモチダ®などが用いられます。卵巣刺激法はいくつかの方法がありますが、次頁の図10に多く用いられており、成績も良好な方法を示します。
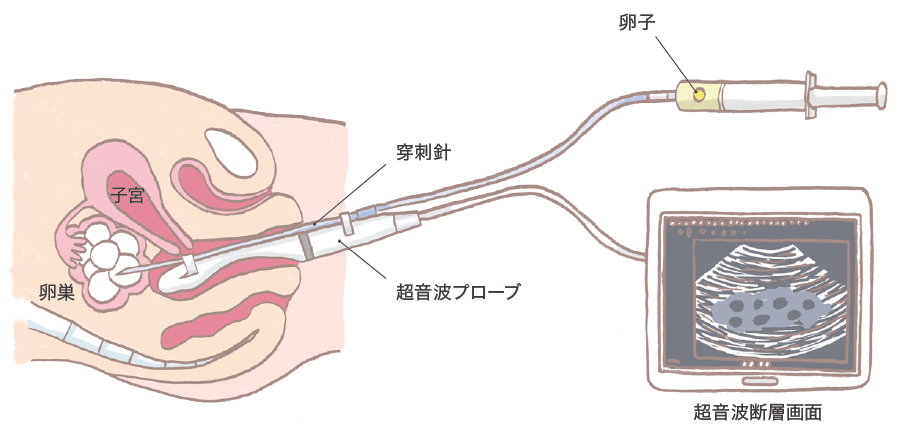
2)採卵術: 経腟超音波ガイド下採卵術
体外受精・胚移植における採卵は、経腟超音波ガイド下に行われます(図11)。経腟超音波プローブを腟内に挿入し、超音波断層画面を見ながら卵胞を穿刺し、卵胞液とともに卵子を吸引、採取する方法です。
両側卵巣の各卵胞のほとんどを穿刺吸引して終了します。卵子は採取した液の中から顕微鏡を使って見つけます。麻酔は静脈麻酔や腟円蓋部への局所麻酔が用いられます。採卵後は2〜3時間安静にし、腹腔内出血がなければ帰宅できます。
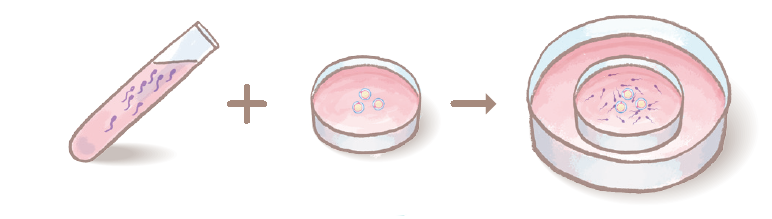
3)媒精と培養
①媒精
採取された卵から体外受精卵を得るために夫の精液から運動精子を効率よく回収し、培養液中で卵子と混ぜ合わせます。この処理を「媒精」といいます。
②受精卵の培養
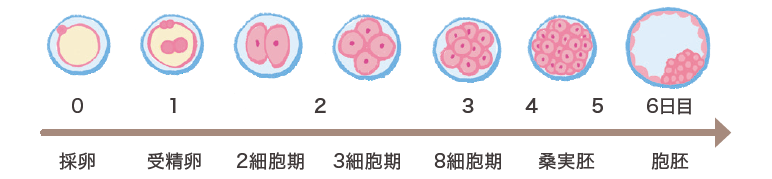
精液から集めた運動精子と卵子は培養器の中で培養され、16~ 18時間後に観察して受精の判定を行います。正常に受精した卵(胚)は、さらに培養を続けて育てます。

4)胚移植
体外受精・胚移植では採卵の2日後に2〜8細胞期の初期胚を移植する初期胚移植と、媒精5〜6日後の胞胚期まで胚を育ててから移植する胚盤胞移植があります。
胚を移植するときは柔らかい移植用チューブに少量の培養液とともに胚を吸引し、子宮頸管を経て子宮腔内に挿入し注入します。移植の精度を上げるために超音波で観察しながら胚移植を行います。
治療後は、合併症の発生に注意をはらいながら普段通りの生活ができます。この間、着床を促進する目的でプロゲステロン製剤などの投与を行います。移植後2週間程度、高温相が続けば妊娠している可能性が高く、妊娠確認検査を行います。
| ①重度の乏精子症・精子無力症 | 運動精子数100万/mL以下、または運動率15%未満 |
|---|---|
| ②運動精子数 | ≦500万/mLで通常の体外受精では受精が困難な症例 |
| ③無精子症 | TESE(testicular sperm extraction)で精巣精子が採取可能な症例 TESE:精巣内精子回収法 |
| ④受精障害 | 通常の体外受精で著しく受精率が低い症例 |
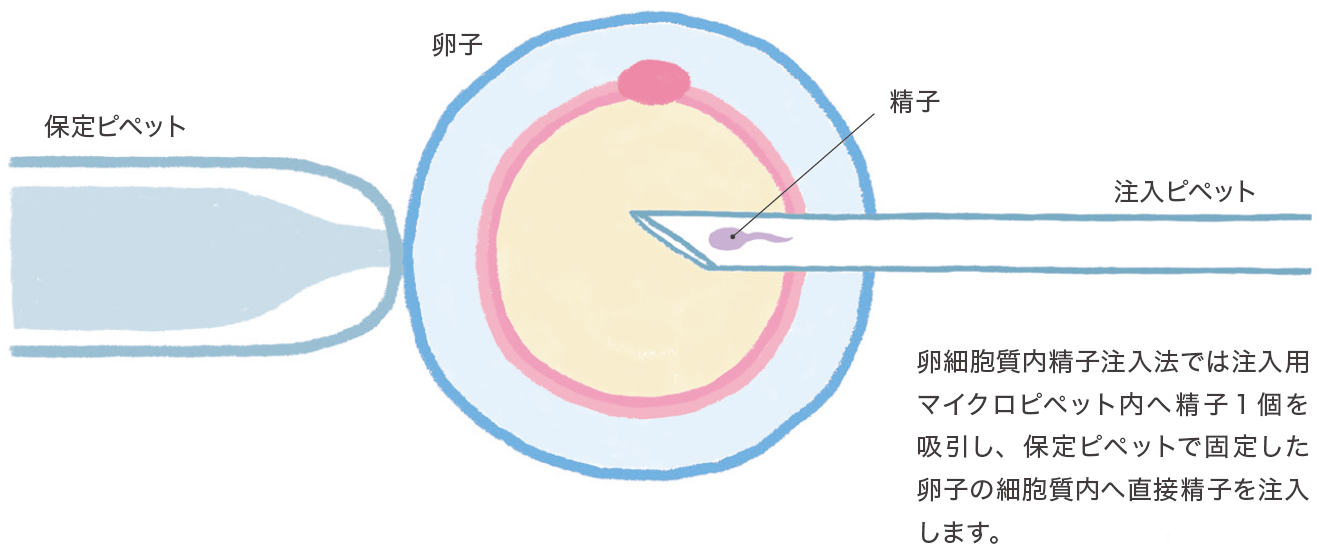
5)顕微授精
重度の乏精子症や精子無力症においては媒精しても受精卵が得られないことがあります。また精液所見が正常でも、体外受精では全く受精卵の得られない症例も存在します。このような症例に対しては顕微授精(卵細胞質内精子注入法; ICSI: intracytoplasmic sperm injection)が行われます。
この方法では射精精子のみならず精巣上体や精巣から外科的に採取した精子を用いることも可能です。一般に受精率は50〜70%であり、操作により10%程度卵子が損傷し変性しますが、顕微授精により受精した胚移植の成績は体外受精に劣らず良好な成績が得られます(表4)。
無精子症に対する生殖補助医療(ART)
男性不妊症の原因には、精巣に障害はなくても精子の輸送路の通過障害があるため精液の中に精子が存在しない閉塞性無精子症があります。閉塞性無精子症のなかには手術で精路の再建が可能な症例もありますが、精路の再建が困難な症例には精巣や精巣上体から外科的に精子を採取し、生殖補助医療で用いることが可能です。また、造精機能の著しく低下した非閉塞性無精子症でも精子を採取できる可能性があります。
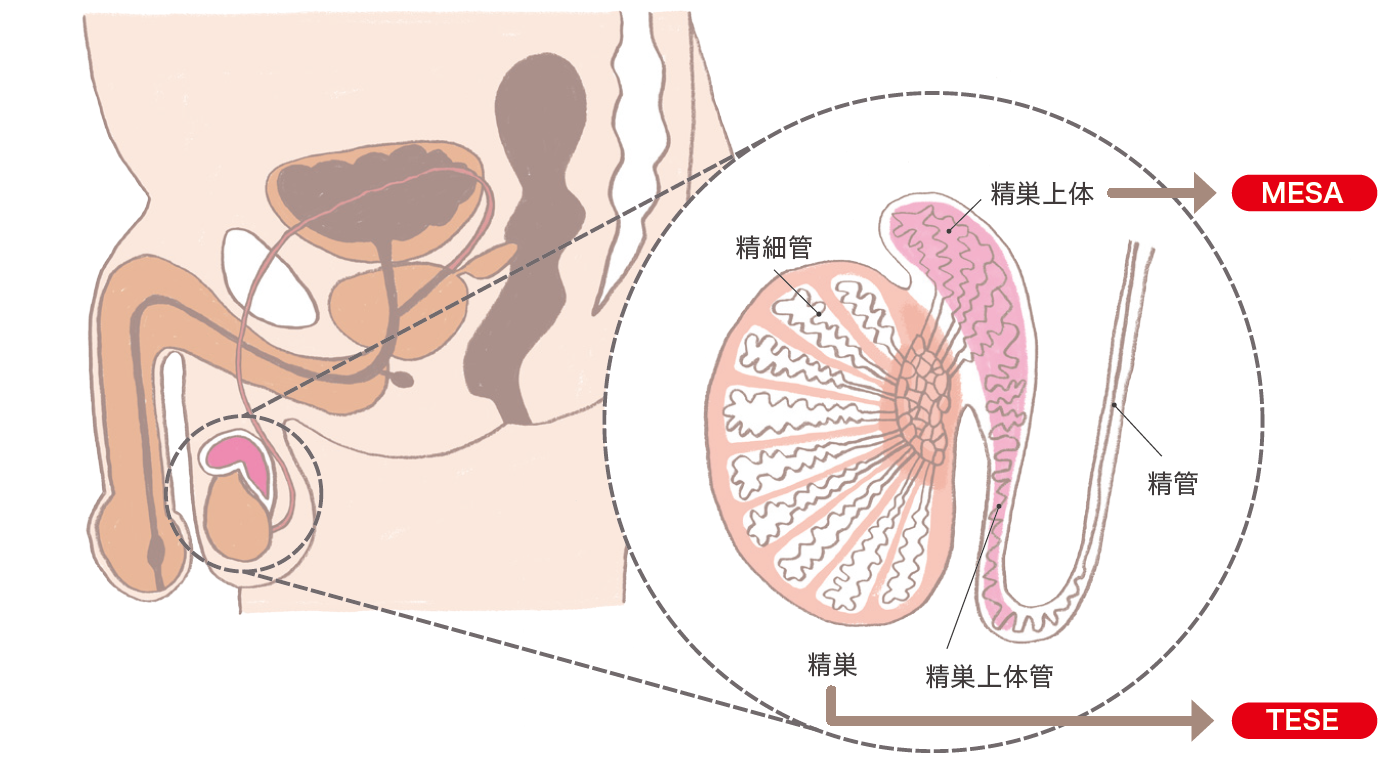
1)精巣から精子を採取する方法
①TESE(testicular sperm extraction :精巣精子採取術)
閉塞性無精子症など、射精された精液の中に精子を認めないが造精機能はあり、精子が回収できると予想された症例が適応となります。陰嚢を切開し、精巣から精巣組織を一部採取して、その中から精子を探し出します。採取された精子を用いて顕微授精(ICSI)を行います。
②MD-TESE(microdissection testicular sperm extraction : 顕微鏡下精巣精子採取術)
特発性造精機能障害やKlinefelter症候群など、造精機能が低下している非閉塞性無精子症の場合が適応です。顕微鏡で精巣を観察し、精子が存在する可能性の高い、太い精細管を採取して精子を探します。
2)精巣上体から精子を採取する方法
①MESA(microsurgical epididymal sperm aspiration)
閉塞性無精子症に対して顕微鏡下に精巣上体管を穿刺または切開して精子を吸引採取します。
②PESA(percutaneous epididymal sperm aspiration)
局所麻酔下に精巣上体を針で穿刺して精子を吸引採取する方法です。
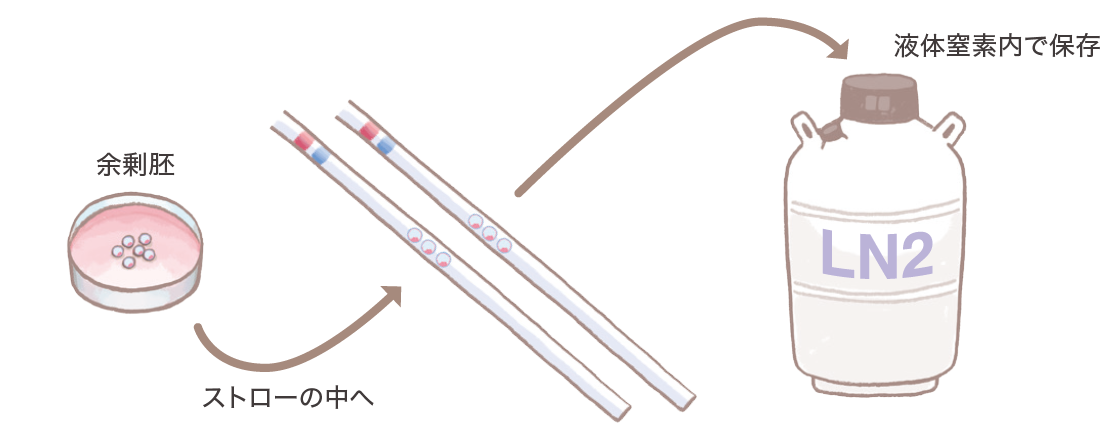
胚の凍結保存
体外受精の卵巣刺激からは複数個の採卵が可能ですが、日本産科婦人科学会の会告では移植胚数は原則1個、条件により2個までとされており、その場合、移植されず余った胚は凍らせて液体窒素の中で保存し、新しい周期の適切な時期に融解して移植することが可能です。液体窒素中で胚は半永久的に保存可能ですが、胚の保存期間は各施設ごとに設定されています。
移植胚数について
移植胚の数の増加に伴い妊娠率は高くなりますが、一方で周産期管理が困難になる多胎の頻度が増加します。多胎妊娠は母体の合併症や早産の危険性が高いため、生殖補助医療に伴って発生する多胎を減少させることが近年の重要な課題となっています。多胎を防ぐために日本産科婦人科学会では「移植する胚は原則として単一とする。ただし、35歳以上の女性、または2回以上続けて妊娠不成立であった女性などについては、2胚移植を許容する」と決めています。
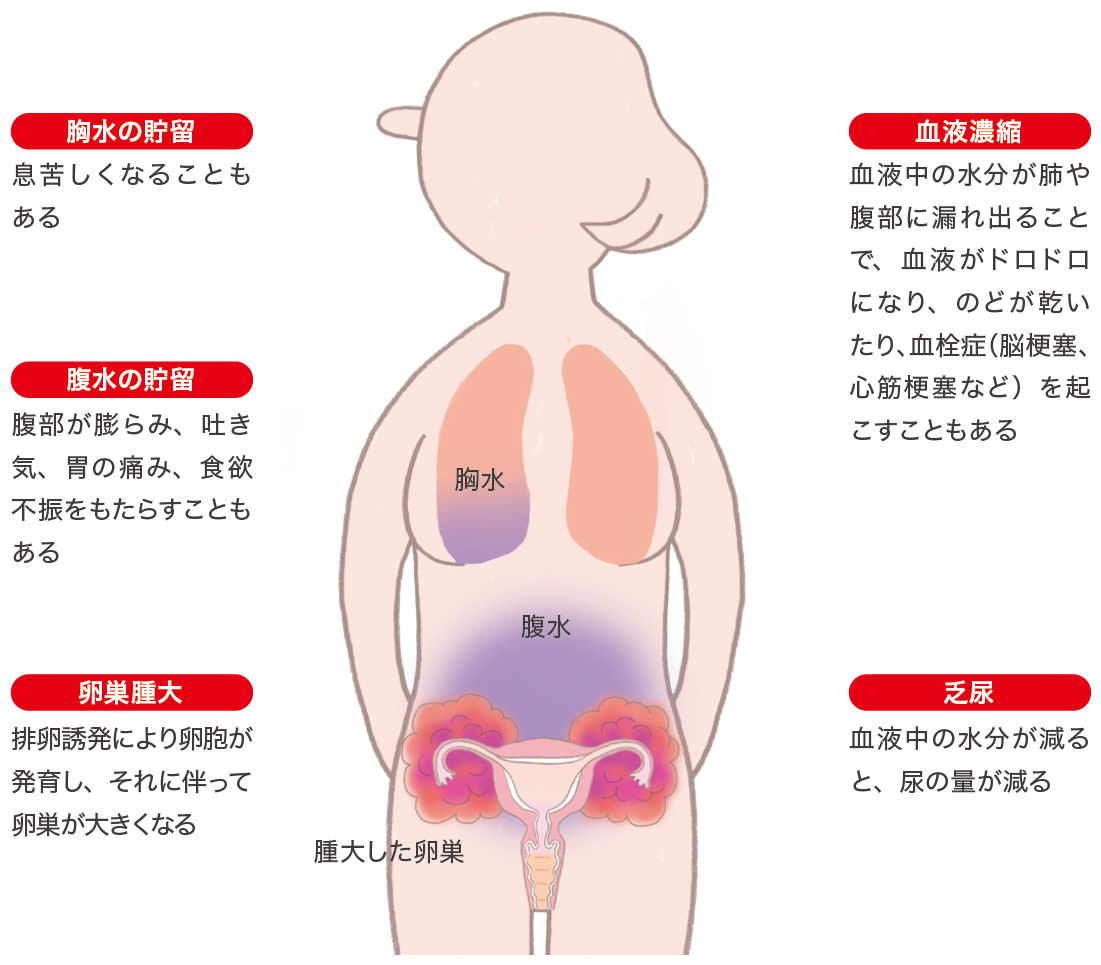
体外受精・胚移植の合併症
①卵巣過剰刺激症候群(ovarian hyperstimulation syndrome : OHSS)
卵巣過剰刺激症候群(OHSS)は排卵誘発に伴って生じます。軽〜中等症では経過観察でよくなりますが、重症化すると多量の腹水・胸水が貯留し、血液濃縮が進むと、時に血栓症(脳梗塞、心筋梗塞など)を起こすこともあり、適切な管理が必要です。胚移植周期の約2〜5%に入院管理を要するOHSSが発症します。卵巣過剰刺激症候群は妊娠成立に伴ってより重くなる危険性があるため、採卵後の状態によっては新鮮胚の移植を中止し、すべての胚をいったん凍結保存することもあります。
②骨盤内感染
採卵時に雑菌が骨盤内に入ると、骨盤腔や卵巣周囲に細菌感染を起こし膿瘍を形成するような骨盤腹膜炎を起こす可能性があります。清潔な操作と抗菌薬の投与により予防します。
③腹腔内出血、卵巣出血、膀胱出血
卵巣および腹膜を経腟的に穿刺する採卵術では、卵巣出血などによる腹腔内出血や経膀胱的な卵巣穿刺による膀胱出血を生じる可能性があります。大部分の症例ではこれらの出血は自然に止血しますが、稀に多量出血に至ることがあります。
| 新鮮胚 | 凍結胚 | ||
|---|---|---|---|
| 体外受精 | 顕微授精 | ||
| 採卵あたりの妊娠率 | 3.8% | 2.3% | |
| 胚移植あたりの妊娠率 | 23.6% | 18.8% | 36.9% |
| 妊娠あたりの多胎率 | 2.8% | 3.3% | 3.1% |
| 妊娠あたりの流産率 | 24.6% | 25.0% | 24.8% |
3)令和4年度臨床倫理監理委員会 登録・調査小委員会報告(2021年分の体外受精・胚移植等の臨床実施成績)より
治療成績
体外受精・胚移植など生殖補助医療(ART)の主な成績は表5のとおりです。
①子宮外妊娠
子宮外妊娠は妊娠例に対し1〜2%の頻度で発生し、特に卵管因子の不妊症例で多いとされています。
②多胎妊娠
約4%ですが、単一胚移植での多胎率は約1%になります。
③先天異常
先天異常の発生率は約1〜2%であり、自然妊娠での発生率と同等と考えられます。また先天異常の種類も自然妊娠と同様であり、特徴的なものはありません。一部の重度男性不妊などでは造精機能異常が次世代に伝わる可能性があります。
④年齢別治療成績
生殖補助医療の治療成績は加齢とともに低下するといわれています。
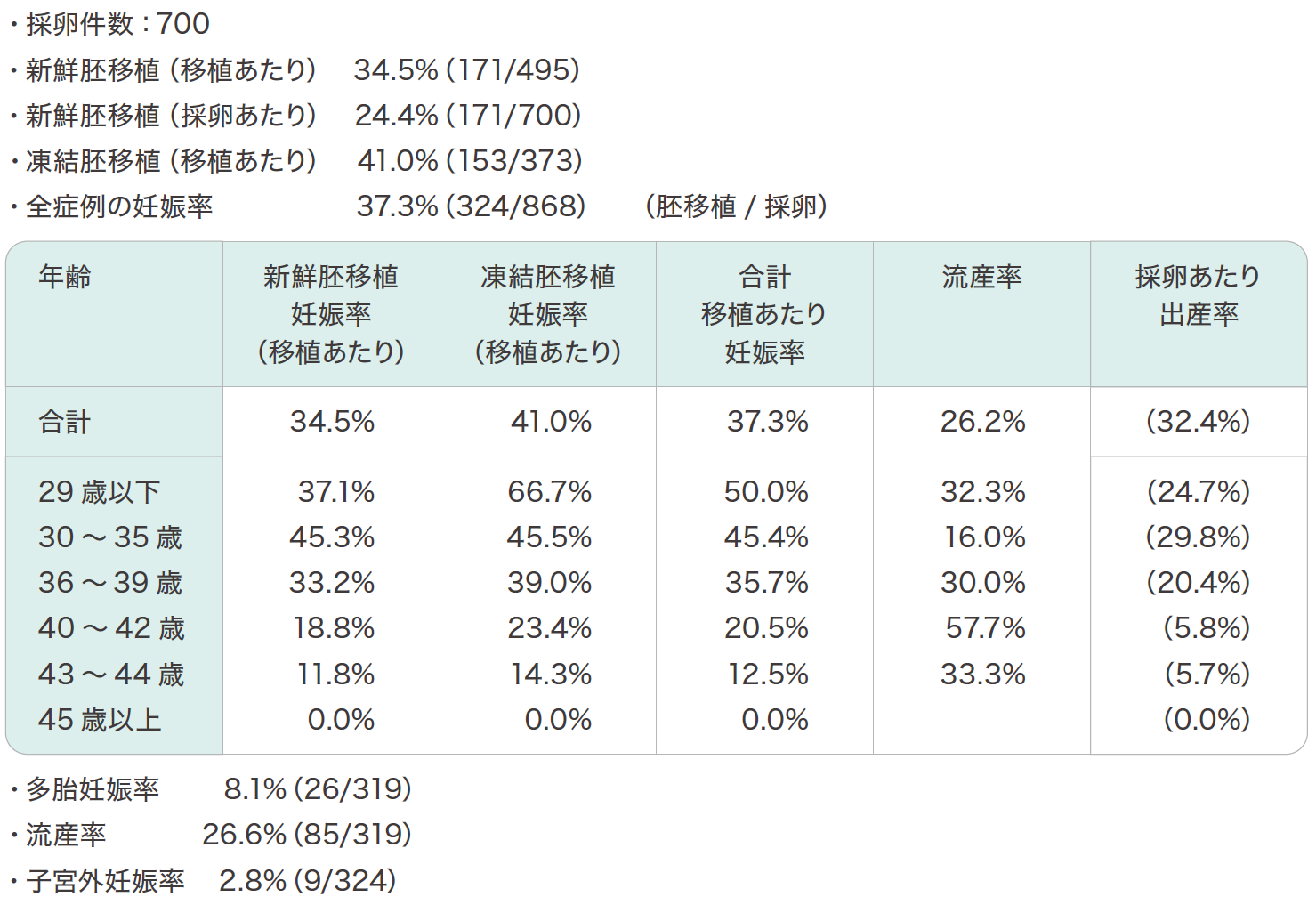
(徳島大学 2009年~2013年)
(2) ARTの応用
| 高リスク(>80%) | ・白血病などへの造血細胞移植・卵巣を含む外照射 ・乳癌(40歳以上)へのCMP/CEF/CAF療法 |
|---|---|
| 中等度リスク | ・乳癌(30~39歳)へのCMP/CEF/CAF療法 ・乳癌(40歳以上)へのAC療法 |
| 低リスク(<20%) | ・Hodgkin病へのABVD療法 ・non-Hodgkin病へのCHOP/CVP療法 ・AML(急性骨髄腫白血病)治療 ・ALL(急性リンパ性白血病)治療 ・乳癌(30歳未満)へのCMP/CEF/CAF療法 ・乳癌(40歳未満)へのAC療法 |
| 超低リスクまたは無リスク | ・ビンクリスチン、メトトレキサート、フルオロウラシル |
| 不明 | ・タキサン系、オキサリプラチン、イリノテカン、モノクロナール抗体、チロシンキナーゼ阻害薬 |
CMP:シタラビン+6-メルカプトプリン+プレドニゾロン
CEF:シクロホスファミド+エピルビシン+フルオロウラシル
CAF:シクロホスファミド+アドリアマイシン+フルオロウラシル
AC:アドリアマイシン+シクロホスファミド
ABVD:アドリアマイシン+ブレオマイシン+ビンブラスチン+ダカルバジン
CHOP:シクロホスファミド+ドキソルビシン+ビンクリスチン+プレドニゾロン
CVP:シクロホスファミド+ビンクリスチン+プレドニゾロン
4)ASCOガイドラインから抜粋、2006
妊孕性(にんようせい)の保存
体外受精の進歩により受精した卵子(受精卵)や胚を凍結することが日常的に可能となり、受精する前の卵子(未受精卵子)の凍結も成功率が高くなりました。この技術を応用して卵子や受精卵・胚を長期間、凍結保存して、将来妊娠を計画することを「妊孕性の保存(温存)」と言います。
卵巣に放射線を大量に当てたり、一部の抗がん薬治療で、卵巣に残っている卵子が枯れてしまう可能性がある時(表7)に検討するのが、医学的適応による妊孕性の保存です。
1)パートナーがいる場合
既婚女性では、凍結・保存の成績が良く、将来の妊娠が期待できる「受精卵・胚」を保存することが勧められます。通常の体外受精技術をそのままを応用するため、技術的にも安心できます。将来、がん治療が落ちついて、主治医から妊娠の許可が出たら、融解胚移植を行うことで、妊娠を期待します。
がんは命を落とす可能性のある病気ですから、第一優先は患者さんの命です。
一方、晩婚化の影響で、がん治療と将来の妊娠を同時に悩む状況に「突然」追い込まれる女性にとって、医学的適応による妊孕性の保存は朗報かもしれません。
がん治療の専門家と生殖医療(体外受精)の専門家が共同して、がん治療の前や途中で卵子(受精卵・胚)の凍結を行う妊孕性温存治療に関するガイドライン、見解などが発表され、がん治療を受けている患者さんが「妊孕性温存治療」を行う機会が増えています。
2)未婚、パートナーがいない場合
未婚でパートナーがいない場合は、採卵した卵子(未受精卵)を凍結保存します。未受精卵子は受精卵・胚に比べて凍結に不向きですが、それでも以前に比べれば、かなり期待がもてる状態になりました(表8)。
融解した後も、受精・胚の各段階まで、すべての卵子が発育することはないので、胚に比べて多数の卵子が必要とされます。絶対に将来の妊娠を保証できる技術ではありませんが、がん治療に取り組みながら、将来の妊娠にも期待を持てることは朗報です。
| 長所 | 短所 | |
|---|---|---|
| 未受精卵子 | ・パートナーが居なくても実施可能 | ・凍結・融解の成績がやや不安定 ・将来の妊娠の可能性がやや低い(1個あたり10%以下) ・費用が高い ・長期間保存する必要がある |
| 受精卵・胚 | ・凍結・融解の成績は安定している ・将来の妊娠の可能性がある程度高い(1個あたり10~40%) | ・パートナーがいないと実施不可能 ・夫婦でないと不可能 ・費用が高い ・長期間保存する必要がある |
(筆者作成)
3)「医学的適応による妊孕性の保存」を希望される場合
担当のがん専門医の先生と相談の上、学会のホームページ(HP)などから正確な情報を得た上で、「医学的適応による妊孕性の保存」を行っている病院で、生殖専門医と相談を行い、治療を行ってください。
関連URL①
日本産科婦人科学会
- 検索語欄に「医学的適応による未受精卵子凍結 見解」と入れてください。医学的適応による妊孕性の保存 見解を見ることができます。
関連URL②
日本がん・生殖医療学会
医学的理由とは関係のない卵子の保存(社会的卵子凍結)
「医学的適応による妊孕性の保存」と同じ方法で、将来の妊娠の可能性を残す「社会的卵子凍結(Social freezing)」を考える独身女性が増えています。35歳を超えると妊娠率は、はっきりと低下しはじめます。パートナーが決まっていない、今は生めないなどの理由で、未受精卵子凍結を選択することは可能です。
しかし「社会的卵子凍結」を考える場合、以下のことが悩ましいところです。
- 1)年齢とともに卵子の数が減るので、一回に採卵できる卵子の数が少ない。
- 2)年齢とともに卵子の質が低下するので、受精~妊娠しない卵子が増える。
- 3)体外受精と卵子の長期間保存のための費用が、思った以上に高額。
- 4)体外受精には、副作用(卵巣過剰刺激症候群、感染症など)がある。
- 5)でも、他に選択肢がない(じっくり考える時間が無い、根本的な治療法が無い)
気がついた時には既に、量・質の両面で、残した卵子で妊娠できる可能性は高くない方が多いのが現実です。「社会的卵子凍結」は「高くて不確実な買い物」であることに注意が必要です(表8参照)。
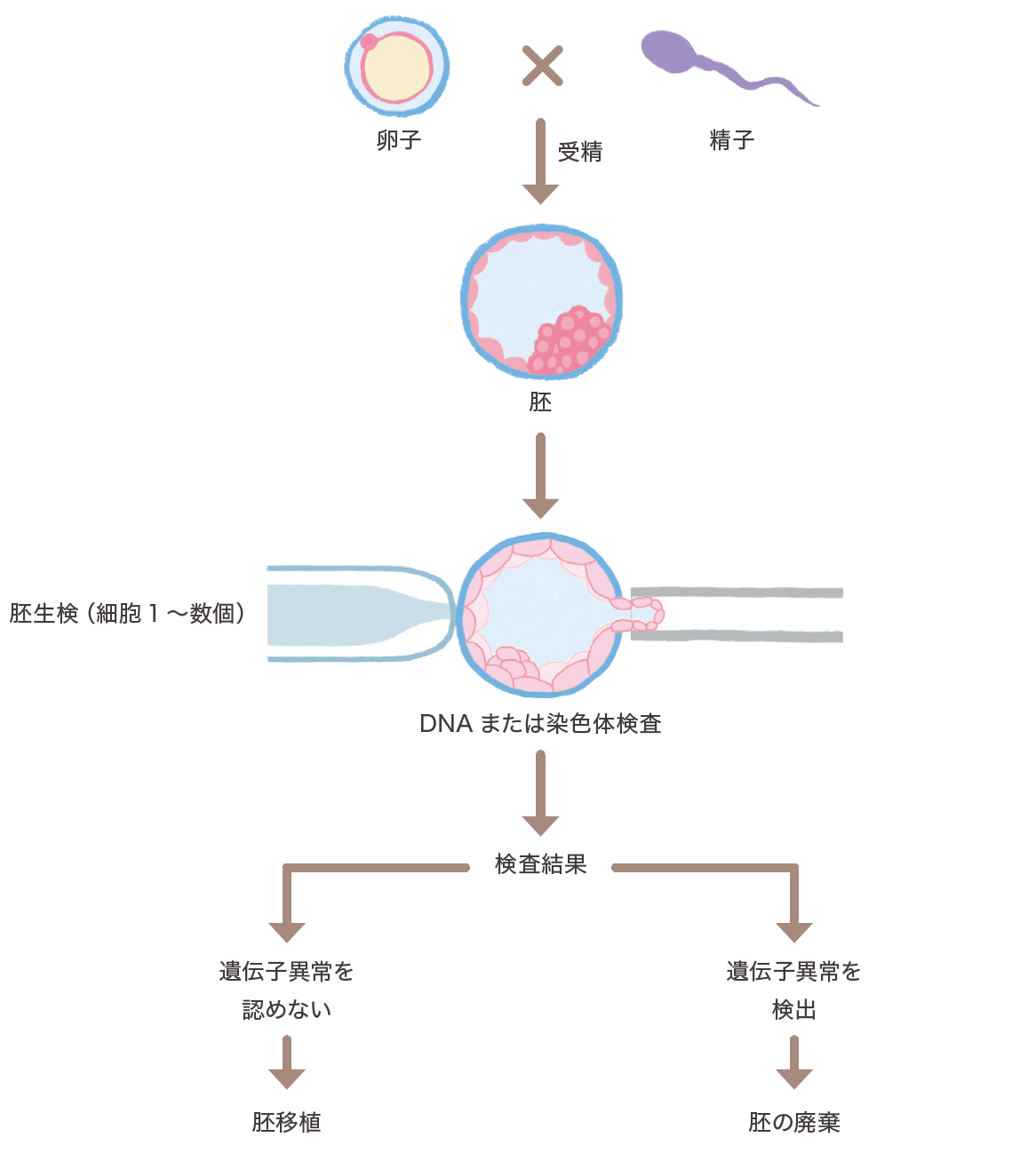
着床前胚異数性検査(PGT-A)
体外で発育している胚を子宮へ移植するか、しないかを判断する目的で、胚の一部を取り出し(胚生検)、染色体数を調べる検査を行うことを着床前胚異数性検査(preimplantation genetic test-aneuploidy : PGT-A)と言います。
夫婦のいずれかに遺伝学的リスクがあり、受精卵によって遺伝学的リスクが異なる場合、自然妊娠可能であってもPGT-Aを目的として体外受精を行うことがあります。PGT-Aにより病気を持っている可能性が低い胚を子宮へ移植することが可能です。一部の疾患で試みられていますが、倫理的配慮から一例毎に、その実施は慎重に検討されています。
着床前胚異数性検査(PGT-A)
染色体数が合わない胚(異数性胚)の大半は移植しても妊娠しないか、流産する(ごく一部の異数性胚は出生に至る)ことがわかっていますが、移植前に顕微鏡で見て異数性胚を判別することは困難です。トリソミー、モノソミー、3 倍体などの異数性胚の移植を避けることができれば、体外受精の成功率を高めることが理論的には可能です。
染色体数が合っている胚のみを移植する目的で、胚生検を行い、染色体数を検査するPGT-A は、特定の遺伝子のみを検査する着床前遺伝子診断(preimplantation genetic diagnosis; PGD)と比べ、1 番から22 番までの常染色体と性染色体のすべてを対象に染色体数を検査するので、胚異数性という言葉を用いていますが、これにより遺伝情報すべてを読み取り、胚を選別するわけではありません。しかし、技術が進歩すると将来、さまざまな方法、考え方で胚を選択することにつながる技術でもあります。
現在、科学的効果の検証と倫理的視点から、専門家の間で議論が進んでいます。
